BENTUK MOLEKUL DAN GAYA
ANTAR MOLEKUL
- BENTUK MOLEKUL
- Bentuk Molekul Berdasarkan Teori VSEPR
Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada tolakan pasangan electron disekitar atom pusat. Teori talakan pasangan electron ini dikenal dengan istilah VSEPR (Valence Shell Electron Pair of Repulsion)
Bentuk molekul didasarkan kepada jumlah electron yang saling tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh munkin untuk meminimumkan tolak elektron
Kelompok pasangan elektron dapat berupa ikatan tunggal, ikatan rangkap
dua, dan ikatan rangkap tiga. Perhatikan Gambar
dua, dan ikatan rangkap tiga. Perhatikan Gambar
Gambar Pasangan elektron di sekeliling atom pusat
Di dalam klasifikasi VSEPR ada beberapa huruf yang melambangkan atom
pusat, atom yang mengelilingi atom pusat, dan pasangan elektron bebas, yaitu:
A = atom pusat
X = atom yang mengelilingi atom pusat
E = pasangan elektron bebas
Berbagai bentuk molekul berdasarkan teori tolakan pasangan elektron
pusat, atom yang mengelilingi atom pusat, dan pasangan elektron bebas, yaitu:
A = atom pusat
X = atom yang mengelilingi atom pusat
E = pasangan elektron bebas
Berbagai bentuk molekul berdasarkan teori tolakan pasangan elektron
dijelaskan sebagai berikut.
1. Bentuk Molekul dengan Dua Pasangan Elektron di
Sekitar Atom Pusat
Sekitar Atom Pusat
Tabel Bentuk molekul dengan dua pasangan elektron di sekitar atom pusat
Dua pasangan elektron yang berada di sekitar atom pusat akan tolak-menolak
membentuk susunan elektron yang linier.
Catatan:
Pasangan elektron bebas pada Cl dan O tidak mempengaruhi bentuk molekul,
karena hanya pasangan elektron yang mengelilingi atom pusat saja yang terlibat
dalam pembentukan molekul
membentuk susunan elektron yang linier.
Catatan:
Pasangan elektron bebas pada Cl dan O tidak mempengaruhi bentuk molekul,
karena hanya pasangan elektron yang mengelilingi atom pusat saja yang terlibat
dalam pembentukan molekul
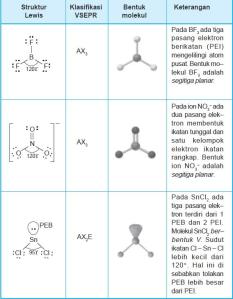
2. Bentuk Molekul dengan Tiga Pasangan Elektron di
Sekitar Atom Pusat
Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan tiga pasangan elektron di sekitar atom
pusat
pusat
Molekul atau ion yang memiliki 3 pasang elektron di sekitar atom pusat baik
pasangan yang membentuk ikatan tunggal atau rangkap membentuk segitiga planar
pasangan yang membentuk ikatan tunggal atau rangkap membentuk segitiga planar
3. Bentuk Molekul dengan Empat Pasangan Elektron di
Sekitar Atom Pusat
Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan empat pasangan elektron di sekitar
atom pusat
atom pusat
semua molekul atau ion yang memiliki empat pasangan elektron di sekitar
atom pusatnya akan membentuk struktur ruang elektron tetrahedral.
Catatan:
Jika ada 4 kelompok elektron yang mengelilingi atom pusat, maka gaya tolak:
PEB – PEB > PEI – PEB > PEI – PEI.
atom pusatnya akan membentuk struktur ruang elektron tetrahedral.
Catatan:
Jika ada 4 kelompok elektron yang mengelilingi atom pusat, maka gaya tolak:
PEB – PEB > PEI – PEB > PEI – PEI.
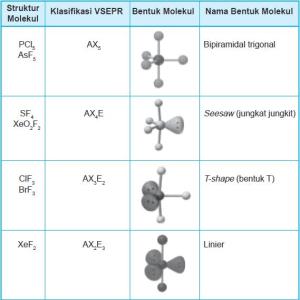
Bentuk Molekul dengan Lima Pasangan Elektron di
Sekitar Atom Pusat
Semua molekul atau ion yang atom pusatnya dikelilingi lima atau enam
pasangan elektron biasanya atom pusat tersebut berasal dari unsur periode ke-3
atau lebih dari 3.
Bentuk-bentuk molekul dengan 5 pasangan elektron yang terdiri dari PEB
dan PEI yang berbeda dapat dilihat pada Tabel
Sekitar Atom Pusat
Semua molekul atau ion yang atom pusatnya dikelilingi lima atau enam
pasangan elektron biasanya atom pusat tersebut berasal dari unsur periode ke-3
atau lebih dari 3.
Bentuk-bentuk molekul dengan 5 pasangan elektron yang terdiri dari PEB
dan PEI yang berbeda dapat dilihat pada Tabel
Jika lima pasangan elektron mengelilingi atom pusat maka akan membentuk
struktur ruang elektron bipiramidal trigonal.
struktur ruang elektron bipiramidal trigonal.
5. Bentuk Molekul dengan Enam Pasangan Elektron di
Sekitar Atom Pusat
Enam pasangan elektron yang mengelilingi atom pusat akan membentuk
struktur ruang elektron oktahedral.
Bentuk-bentuk molekul yang terjadi dari 6 pasangan elektron yang terdiri dari
PEI dan PEB yang berbeda dapat dilihat pada Tabel
Sekitar Atom Pusat
Enam pasangan elektron yang mengelilingi atom pusat akan membentuk
struktur ruang elektron oktahedral.
Bentuk-bentuk molekul yang terjadi dari 6 pasangan elektron yang terdiri dari
PEI dan PEB yang berbeda dapat dilihat pada Tabel
Bentuk molekul dapat diramalkan dengan teori jumlah pasangan elektron di
sekitar atom pusat dan VSEPR. Langkah-langkahnya:
1. Menentukan struktur Lewis dari rumus molekul.
2. Menentukan jumlah pasangan elektron di sekeliling atom pusat, pasangan
elektron ikatan, dan pasangan elektron bebas.
3. Memprediksi sudut-sudut ikatan yang mungkin berdasarkan jumlah kelompok
elektron dan arah-arah yang mungkin akibat tolakan pasangan elektron bebas.
4. Menggambarkan dan memberi nama bentuk molekul berdasarkan jumlah PEI
dan PEB.
sekitar atom pusat dan VSEPR. Langkah-langkahnya:
1. Menentukan struktur Lewis dari rumus molekul.
2. Menentukan jumlah pasangan elektron di sekeliling atom pusat, pasangan
elektron ikatan, dan pasangan elektron bebas.
3. Memprediksi sudut-sudut ikatan yang mungkin berdasarkan jumlah kelompok
elektron dan arah-arah yang mungkin akibat tolakan pasangan elektron bebas.
4. Menggambarkan dan memberi nama bentuk molekul berdasarkan jumlah PEI
dan PEB.
Langkah-langkah tersebut diilustrasikan sebagai berikut
Contoh Soal
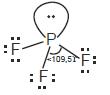
Ramalkan bentuk molekul PF3 dan COCl2
Ramalkan bentuk molekul PF3 dan COCl2
• Jumlah pasangan elektron di sekeliling P = 4 pasang,
3 PEI dan 1 PEB, klasifikasi VSERP: AX3E
• Bentuk molekul PF3 adalah piramidal trigonal
dengan sudut F–P–F < 109,5°
3 PEI dan 1 PEB, klasifikasi VSERP: AX3E
• Bentuk molekul PF3 adalah piramidal trigonal
dengan sudut F–P–F < 109,5°
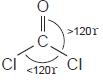
b. Bentuk molekul COCl2
• Struktur Lewis COCl
• Struktur Lewis COCl
• Bentuk ideal COCl2 adalah segitiga planar dengan sudut 120 tetapi
karena ada ikatan rangkap yang tolakannya lebih besar terhadap ikatan
tunggal maka sudut Cl – C – O > 120° dan Cl – C – Cl < 120°.
• Bentuk molekul COCl2 adalahsegitiga dengan sudutsudut
sebagai berikut
karena ada ikatan rangkap yang tolakannya lebih besar terhadap ikatan
tunggal maka sudut Cl – C – O > 120° dan Cl – C – Cl < 120°.
• Bentuk molekul COCl2 adalahsegitiga dengan sudutsudut
sebagai berikut
B. Bentuk Molekul Berdasarkan Teori Hibridisasi
Teori jumlah pasangan elektron di sekitar atom pusat dapat menjelaskan
berbagai bentuk-bentuk molekul sesuai dengan eksperimen. Ada lagi teori yang
dapat menjelaskan bentuk molekul yaitu berdasarkan bentuk orbital kulit terluarnya
Teori jumlah pasangan elektron di sekitar atom pusat dapat menjelaskan
berbagai bentuk-bentuk molekul sesuai dengan eksperimen. Ada lagi teori yang
dapat menjelaskan bentuk molekul yaitu berdasarkan bentuk orbital kulit terluarnya
Pada pembentukan molekul ini terjadi penggabungan beberapa orbital suatu atommembentuk orbital baru yang tingkat energinya sama atau orbital hibrid. Prosesini dikenal dengan istilah hibridisasi
1. Bentuk Molekul BeF2
Konfigurasi elekron atom 4Be: 1s2 2s2. Atom Be mempunyai dua elektron pada
orbital 2s. Agar terdapat dua elektron yang tidak berpasangan untuk mengikat
dua atom F maka satu elektron dari 2s pindah ke 2p atau tereksitasi. Orbital s danp tersebut mengalami hibridisasi membentuk orbital hibrid sp yang berbentuk linierKonfigurasi elektron terluar Be :
Konfigurasi elektron Be terhibridisasi :
Konfigurasi elektron Be pada BeF2 :
Konfigurasi elekron atom 4Be: 1s2 2s2. Atom Be mempunyai dua elektron pada
orbital 2s. Agar terdapat dua elektron yang tidak berpasangan untuk mengikat
dua atom F maka satu elektron dari 2s pindah ke 2p atau tereksitasi. Orbital s danp tersebut mengalami hibridisasi membentuk orbital hibrid sp yang berbentuk linierKonfigurasi elektron terluar Be :

Konfigurasi elektron Be terhibridisasi :
Konfigurasi elektron Be pada BeF2 :
Dua elektron tidak berpasangan pada 
orbital ini akan menerima elektron dari
F membentuk ikatan kovalen sehingga
BeF2 berbentuk linier.

orbital ini akan menerima elektron dari
F membentuk ikatan kovalen sehingga
BeF2 berbentuk linier.







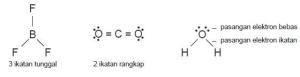



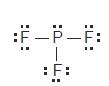



0 komentar:
Posting Komentar